10 невероятно опасных химических веществ

Несмотря на то, что мы буквально купаемся в них, химические вещества не славятся хорошей репутацией. Некоторые из них могут быть полезны, но практически все будут ядом при определенных условиях. Химические вещества и реагенты, которые вы найдете в списке ниже, будут опасны даже в идеальных условиях. Чрезвычайно опасны.
Бромистый этидий
Современный биолог должен знать принципы работы с ДНК. Проблема в том, что ДНК совершенно невидима в концентрациях, которые использует большинство людей. Если вы хотите изолировать фрагменты ДНК, их нужно раскрасить. Бромистый этидий идеально подходит в качестве красителя ДНК. Он красиво флуоресцирует и тесно цепляется за ДНК. Что еще нужно для счастья? Может, чтобы это соединение не вызывало рак?
Бромистый этидий окрашивает ДНК, протискиваясь между парами оснований. Это приводит к нарушению целостности ДНК, поскольку присутствие бромистого этидия вызывает напряжение в структуре. Места разрывов становятся площадками для мутаций.
А вот мутации, как известно, чаще всего нежелательны. Притом что вам нужно использовать ультрафиолетовый свет, еще один канцерогенный агент, чтобы визуализировать краситель, что явно не сделает компонент безопаснее. Многие ученые, работающие с ДНК, предпочитают использовать более безопасные соединения для окрашивания дезоксирибонуклеиновой кислоты.
Диметилкадмий
Свинец, ртуть и все их друзья вызывают различные проблемы со здоровьем, попадая в организм человека. В некоторых формах эти тяжелые металлы могут проходить через тело, не поглощаясь. В других они легко захватываются. Оказавшись внутри, они начинают вызывать проблемы.
Диметилкадмий вызывает серьезные ожоги кожи и повреждения глаз. Также это яд, который накапливается в тканях. Кроме того, если физиологических эффектов недостаточно, это химическое вещество горюче в жидкой и газообразной формах. Взаимодействия с воздухом достаточно, чтобы поджечь его, а вода только усугубляет процесс горения.
В процессе горения диметилкадмий производит оксид кадмия - еще одно вещество с неприятными свойствами. Оксид кадмия вызывает рак и гриппоподобному заболеванию под названием «литейная лихорадка».
VX, как называют Venomous Agent X («отравляющий агент X»), это химическое вещество, которому не нашли применения за пределами химического оружия. Разработанное английской исследовательской военной станцией в Портоне, это вещество без запаха, без вкуса смертельно даже в объеме 10 миллиграммов. Британское правительство торговало информацией о VX с американским в обмен на процесс создания термоядерного оружия.
VX с легкостью впитывается в кожу. Кроме того, он не сразу распадается в окружающей среде, поэтому атака с применением VX приведет к долгосрочным последствиям. Одежды, которую носили во время воздействия вещества, будет достаточно, чтобы отравить любого, вступившего с ней в контакт. Воздействие VX мгновенно убивает, вызывая судороги и паралич. Смерть наступает в процессе отказа дыхательной системы.
Триоксид серы
Триоксид серы - это прекурсор серной кислоты, необходимый также для некоторых реакций сульфирования. Если бы триоксид серы не был полезен, ни один здравомыслящий ученый не держал бы его при себе. Триоксид серы чрезвычайно едкий, когда вступает в контакт с органической материей.
Взаимодействуя с водой (которая составляет большую часть нашего тела), он создает серную кислоту с выделением тепла. Даже если он не попал непосредственно на вашу плоть, даже рядом находиться будет весьма опасно. Пары серной кислоты делают плохое с легкими. Проливание триоксида серы на органический материал вроде бумаги или дерева порождает токсичный огонь.
Батрахотоксин
Батрахотоксин - это сложная на вид молекула, которая настолько смертельна, что одна 136-миллионная грамма этого вещества будет смертельной для 68-килограммового человека. Чтобы вы понимали, это примерно две гранулы соли. Батрахотоксин входит в число самых опасных и ядовитых химических веществ.
Батрахотоксин связывается с натриевыми каналами в нервных клетках. Роль этих каналов жизненно важна в мышечных и нервных функциях. Удерживая эти каналы открытыми, химическое вещество устраняет любой мышечный контроль из организма.
Батрахотоксин нашли на коже крошечных лягушек, яд которых использовали для отравленных стрел. Некоторые племена индейцев обмакивали кончики стрел в яд, выделяемый лягушками. Дротики и стрелы парализовали добычу и позволяли охотникам спокойно ее забирать.
Диоксидифторид
Диоксидифторид - это страшное химическое вещество, имеющее также чарующее название FOOF, поскольку к двум атомам фтора крепятся два атома кислорода. В 1962 году химик А. Г. Штренг опубликовал работу под названием «Химические свойства диоксидифторида». И хотя это название не кажется пугающим, эксперименты Штренга определенно таковыми были.
FOOF изготавливается при очень низкой температуре, поскольку распадается при температуре кипения около -57 градусов по Цельсию. Во время своих экспериментов Штренг обнаружил, что FOOF взрывается, вступая в действие с органическими соединениями, даже при температуре -183 градуса Цельсия. Взаимодействуя с хлором, FOOF сильно взрывается, а контакт с платиной приводит к такому же эффекту.
Короче, в разделе результатов в работе Штренга было множество слов «вспышка», «искра», «взрыв», «сильно» и «огонь» в разных комбинациях. Не забывайте, что все это происходило при температурах, при которых большинство химических веществ по сути инертны.
Цианистый калий
Цианид - простая молекула, всего лишь атом углерода, трижды связанный с атомом азота. Будучи небольшой, молекула цианида может просачиваться в белки и делать им очень плохо. Особенно цианид любит связываться с атомами железа в центре гемопротеинов.
Один из гемопротеинов крайне полезен для нас: гемоглобин, белок, переносящий кислород в нашей крови. Цианид избавляет гемоглобин от способности перевозить кислород.
Когда цианистый калий вступает в контакт с водой, он разбивается на цианистый водород, который легко всасывается телом. Этот газ пахнет горьким миндалем, хотя не все могут его учуять.
Из-за быстрой реакции цианистый калий часто использовался как средство для [Роскомнадзор] многими людьми. Британские агенты времен Второй мировой войны носили таблетки цианида на случай поимки, и многие высокопоставленные нацисты также использовали капсулы цианистого калия, чтобы избегать правосудия.
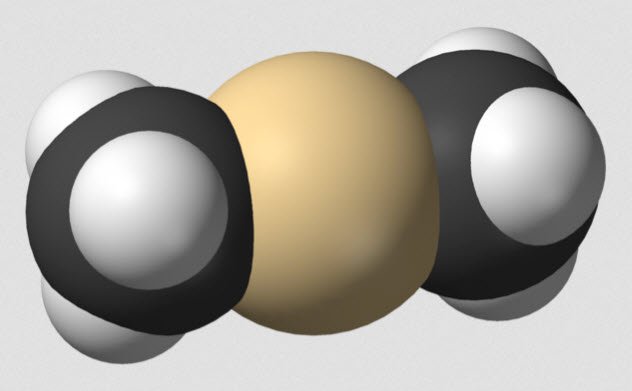
Диметилртуть
Две капли диметилртути - и все.
В 1996 году Карен Веттерхан исследовала эффекты воздействия тяжелых металлов на организмы. Тяжелые металлы в своей металлической форме довольно плохо взаимодействуют с живыми организмами. Хотя это и не рекомендуется, вполне можно опустить руку в жидкую ртуть и успешно ее вынуть.
Поэтому чтобы ввести ртуть в ДНК, Веттерхан использовала диметилртуть, атом ртути с двумя присоединенными органическими группами. В процессе работы Веттерхан уронила каплю, может две, на свою латексную перчатку. Через шесть месяцев она умерла.
Веттерхан была опытным профессором и приняла все рекомендуемые меры предосторожности. Но диметилртуть просочилась через перчатки менее чем за пять секунд, а через кожу - менее чем за пятнадцать. Химическое вещество не оставило никаких явных следов и Веттерхан заметила побочные эффекты лишь несколько месяцев спустя, когда было уже слишком поздно лечиться.
Трифторид хлора
Хлор и фтор по отдельности неприятные элементы. Но если они сочетаются в трифторид хлора, все становится еще хуже.
Трифторид хлора - это настолько коррозионное вещество, что его даже в стекле хранить не получится. Это такой сильный окислитель, что он сможет поджечь вещи, которые даже в кислороде не горят.
Даже пепел вещей, сгоревших в атмосфере кислорода, загорится под действием трифторида хлора. Ему даже не нужен источник воспламенения. Когда 900 килограммов трифторида хлора разлили в результате промышленной аварии, это химическое вещество растворило 0,3 метра бетона и метр гравия под собой.
Единственный (относительно) безопасный способ хранить это вещество - металлический контейнер, который уже был обработан фтором. Таким образом создается фтористый барьер, с которым не реагирует трехфтористый хлор. Встречаясь с водой, трифторид хлора мгновенно взрывается с выделением тепла и плавиковой кислоты.
Плавиковая кислота
Любой, кто работал в области химии, слышал байки про фтористоводородную кислоту. В техническом смысле это слабая кислота, которая нелегко расстается со своим ионом водорода. Поэтому быстрый химический ожог получит от нее довольно сложно. И в этом секрет ее коварства. Будучи относительно нейтральной, плавиковая кислота может проходить через кожу, не уведомляя вас, и попадать в организм. И оказавшись на месте, плавиковая кислота приступает к работе.
Когда кислота отдает свой протон, остается фтор, который вступает в реакцию с другими веществами. Эти реакции нарастают как снежный ком, и фтор сеет ужасный хаос. Одной из любимых целей фтора является кальций. Поэтому плавиковая кислота приводит к гибели костной ткани. Если жертву оставить без лечения, смерть будет наступать долго и больно.